自人类多能干细胞(hPSCs)首次成功建系至今已近三十年,其分化控制与规模化制备技术已取得长足进步,使得基于hPSC的细胞治疗产品逐步进入临床验证阶段。本文基于Kirkeby等人于2025年发表在《Cell Stem Cell》上的综述“Pluripotent stem-cell-derived therapies in clinical trial: A 2025 update”,梳理全球范围内hPSC临床试验的整体格局,总结其在眼科、中枢神经系统、心脏、内分泌、免疫及间质等疾病领域的最-新进展,并分析当前面临的技术、免疫与产业化挑战,展望未来发展方向。

hPSC技术自2007年诱导多能干细胞(hiPSC)问世后迎来爆发,为再生医学提供了几乎无限的细胞来源。截至2024年12月,全球已有115项获监管批准的临床试验,涉及83种hPSC产品,覆盖34种适应症,累计治疗患者超过1,200人,细胞总剂量超过1.9×1011个。研究区域高度集中在美国、中国、日本、欧盟等国家与地区。
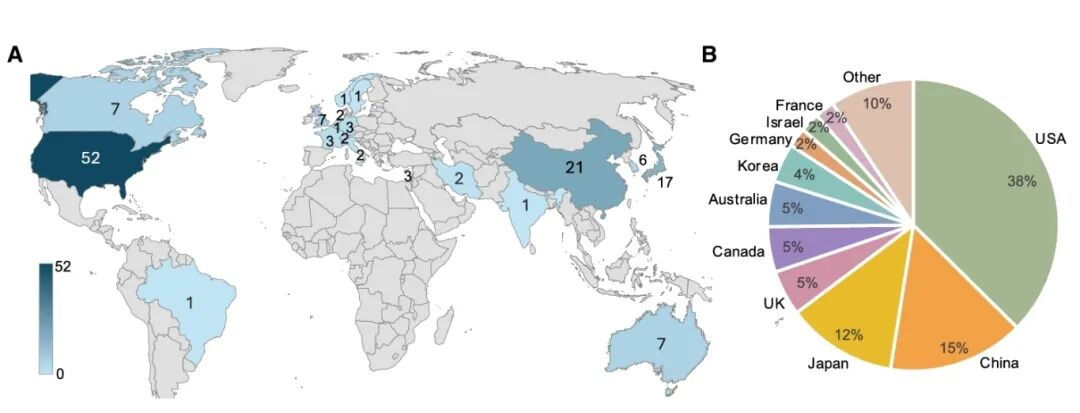
Distribution of hPSC trials per country
临床试验阶段以Ⅰ/Ⅱ期为主,主要关注安全性与初步疗效。从治疗领域看,早期研究主要集中在具有“免疫豁免”特性的眼部与中枢神经系统,近年来则逐步拓展至心脏、糖尿病、免疫肿瘤及血液系统疾病。值得关注的是,目前已报道的临床数据总体显示出良好的安全性,未出现普遍性的严重不良事件或致瘤性报告,为后续研究奠定了信心基础。
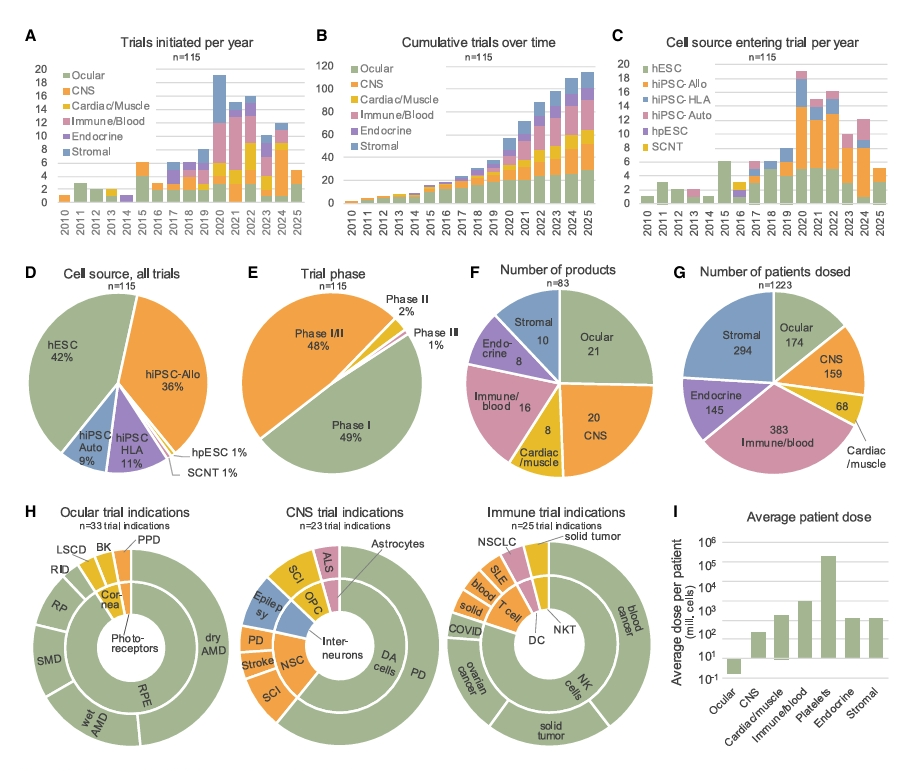
Overview of hPSC trials and dosed patients
-
眼科疾病:视网膜色素上皮移植领跑
眼部因免疫豁免特性成为hPSC治疗的首-选靶点。目前已有至少21种针对年龄相关性黄斑变性(AMD)、Stargardt病、视网膜色素变性等疾病的hPSC产品进入临床。主要策略为移植视网膜色素上皮细胞(RPE),形式包括细胞悬液、单层细胞片及搭载于支架的复合移植物。国内进展较快的公司为济视同光,公司专注于开发iPSC分化的视网膜色素上皮细胞,其核心管线TE02102(iPSC-nRPEC)治疗干性AMD即将正式进入IIT研究,预计25年年底启动患者入组。
-
中枢神经系统疾病:帕金森病成为主战场
帕金森病(PD)因多巴胺神经元进行性丢失而成为hPSC治疗的重点方向。当前已有13项针对PD的临床试验,主要采用hESC或hiPSC来源的多巴胺前体细胞进行脑内移植。
2018年日本京都大学CiRA团队率先开展HLA单倍型hiPSC来源的多巴胺前体细胞移植,初步显示良好的安全性。BlueRock Therapeutics公司基于H9 hESC的Bemdaneprocel产品在Ⅰ期试验中报告高剂量组患者症状改善达50%以上,推动其进入Ⅱ期研究。韩国S.Biomedics、瑞典Lund大学等团队也在开展类似试验。
脊髓损伤方面,首-个hPSC产品GRN-OPC1(后更名为LCT-OPC1)早在2010年进入临床,长期随访显示安全性良好,但疗效有限。近期Neurona Therapeutics针对药物抵抗性癫痫的抑制性中间神经元产品NRTX-1001,在初步研究中显示出显著的癫痫发作减少效果,部分患者甚至达到无发作状态,为神经元移植治疗提供了令人鼓舞的证据。中国的士泽生物公司在帕金森病和脊髓损伤领域取得领-先进展:其治疗帕金森病的iPSC衍生多巴胺能神经前体细胞新药,已在国内启动首-个随机双盲对照的注册临床试验;同时,其针对脊髓损伤的“现货型”iPSC再生脊髓神经细胞新药(XS228)已完成全球首例患者给药,相关注册临床试验已启动。
-
心脏修复:心肌细胞移植迈出第一步
心肌细胞移植旨在修复心肌梗死后的瘢痕组织,恢复心脏收缩功能。现有临床试验多采用心肌细胞悬液、心肌球或心肌片形式,剂量在500万至8亿细胞之间。日本大阪大学团队使用hiPSC来源的心肌细胞片移植后,患者心功能有所改善且未见严重心律失常。德国Repairon公司的心肌-基质细胞复合片亦报告可增强心壁厚度与射血分数。中国艾尔普生物公司旨在治疗重度心力衰竭的“现货型”心肌细胞药物:HiCM-188是全球首-个在中美同时获得IND批准的同类型产品,目前已在中国进入II期临床试验,并在美国、新加坡等地启动了I/II期临床。
-
糖尿病治疗:胰岛β细胞替代曙光初现
Ⅰ型糖尿病因自身免疫破坏胰岛β细胞而需外源性胰岛素治疗。hPSC来源的胰岛细胞移植被视为潜在治愈手段。Viacyte公司早期采用封装装置(Encaptra)联合胰腺内胚层细胞(PEC-01)进行皮下移植,虽安全性良好但细胞存活受限。Vertex Pharmaceuticals(收购Semma Therapeutics)开发的VX-880成熟胰岛细胞产品经门静脉移植,配合免疫抑制,在Ⅰ/Ⅱ期试验中使多名患者实现胰岛素独立或大幅减量,目前正推进至关键Ⅱ/Ⅲ期研究。智新浩正公司开发了国内首-款获得临床试验默示许可的异体通用型再生胰岛细胞候选产品“异体人再生胰岛注射液(E-islet 01)”,用于治疗1型糖尿病。该疗法已于2025年8月启动了I/IIa期临床试验,旨在评估其安全性与初步有效性。
-
免疫与血液系统:CAR-NK与血小板步入临床
异体“现货型”免疫细胞产品可克服自体CAR-T疗法成本高、制备复杂的瓶颈。Fate Therapeutics公司开发了一系列hiPSC来源的NK细胞产品(如FT516、FT538等),通过基因编辑增强其抗肿瘤活性与持久性,在B细胞淋巴瘤、多发性骨髓瘤等血液肿瘤中显示出良好安全性与初步疗效。此外,CAR-T细胞产品(FT819)也在自身免疫病(系统性红斑狼疮)中初显疗效。沙砾生物的GT719是全球首-个由干细胞分化而来并且已经有临床数据的通用型CAR-iNKT细胞疗法,利用NKT细胞的独特杀伤机制,GT719正在IIT阶段同时探索血液肿瘤和自身免疫疾病中的疗效,并已看到了前景可期的初步安全性和疗效信号。
血小板输注依赖症方面,日本团队已实现hiPSC来源血小板的临床输注(MEG-002与IPLAT1),虽未显著提升血小板计数,但验证了其安全性与可行性。国内的血霁生物在iPSC来源血小板产品上进展显著,其全球首-款血小板注射液细胞新药(XJ-PLT-001)于2025年7月再次获得美国FDA孤儿药资格认定,用于治疗先天无巨核细胞性血小板减少症。河络新图则专注于该领域的平台技术研发,根据早前信息,其人工血小板管线尚处于临床前阶段。
-
间充质干细胞:免疫调节应用拓展
hPSC来源的间充质干细胞(MSC)具有免疫调节与组织修复潜能,已用于移植物抗宿主病、骨关节炎、糖尿病足溃疡等疾病。澳大利亚Cynata Therapeutics公司的CYP-001产品在急性激素抵抗性GvHD患者中取得较高应答率,目前正开展骨关节炎的Ⅲ期试验,有望成为首-个进入Ⅲ期阶段的hPSC产品。国内安徽中盛溯源生物科技有限公司开发的“NCR101注射液”是全球首-款获批进入临床试验的iPSC来源基因修饰间充质样细胞治疗产品,拟用于治疗间质性肺病,已于2025年2月获得国家药监局的临床试验默示许可。
-
免疫排斥对策多样化
为减少长期免疫抑制,目前策略包括:①使用自体hiPSC;②建立HLA单倍型干细胞库进行配型;③基因编辑构建“低免疫原性”细胞系;④采用免疫隔离封装装置。其中,眼部与中枢神经系统因具有一定免疫豁免特性,可能仅需短期免疫抑制即可维持移植物存活,为异体治疗提供了便利。
-
产业化与可及性挑战
hPSC产品从实验室走向临床仍需解决大规模制备、质量控制、成本控制及运输储存等问题。尤其是自体疗法虽能避免免疫排斥,但成本高昂、周期长;而异体“现货型”产品则需平衡免疫匹配与规模化生产之间的矛盾。此外,细胞治疗的高昂定价也可能影响其临床可及性,需探索可持续的支付与商业模式。
-
临床试验设计需创新
对于需侵入性操作(如脑内、眼内移植)的疗法,传统安慰剂对照(假手术)设计面临伦理与可行性挑战。未来可能需采用客观生物标志物、历史对照或适应性设计等方式,在确保科学严谨的同时保护患者权益。
hPSC临床治疗历经十余年探索,已从早期安全性验证逐步进入疗效验证与产品优化阶段。全球范围内,眼科与神经系统疾病仍是主攻方向,而心脏、糖尿病、免疫肿瘤等领域的突破也日益显著。尽管在免疫排斥、规模化生产、临床试验设计等方面仍存挑战,但随着基因编辑、细胞工艺、免疫工程等技术的进步,hPSC疗法有望在未来十年内为多种难治性疾病提供新的治疗选择,真正实现再生医学的临床转化。
ACROBiosystems百普赛斯专注于支持细胞疗法相关研究,在完善的细胞培养平台、流式细胞术验证平台以及GMP质量管理体系下,开发了一系列用于iPSC培养及分化用的Premium(Pre-GMP)和GMP级别的BMP4、DLL4、SDF-1a、Activin A、SHH、FGF-8b、FGF basic、BDNF、GDNF、Noggin等细胞因子及Laminin 511、Laminin 521、Fibronectin、Vitronectin等基质蛋白。产品工艺稳定,目前已助力多家iPSC企业开发iPSC到T/NK等免疫细胞、神经细胞、视网膜上皮细胞等工艺,并成功用于临床生产中。




ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)
